【医院新闻】山东大学第二医院郭海洋研究员发表前列腺癌中转录因子动态平衡机制研究成果

世界范围内,前列腺癌在男性实体肿瘤中发生率居第二位。雄激素受体(AR)在前列腺癌的发生发展中起到核心作用,因而雄激素剥夺疗法(药物或手术去势)是治疗转移性前列腺癌的常规疗法。但经去势治疗的前列腺癌能够发展出对这种疗法的抗性,其复发后被称为去势抵抗前列腺癌(CRPC)。在此阶段,进一步抑制雄激素合成的药物(例如abiraterone)以及直接靶向AR的药物(例如enzalutamide)能够抑制CRPC增殖,但大部分病人会在治疗后1—2年内再次复发。近年来一些临床研究表明,周期性和高剂量睾酮给药,可以诱导晚期前列腺癌的临床响应,并恢复既往治疗过CRPC患者对雄激素信号抑制的敏感性,但具体机制未知。
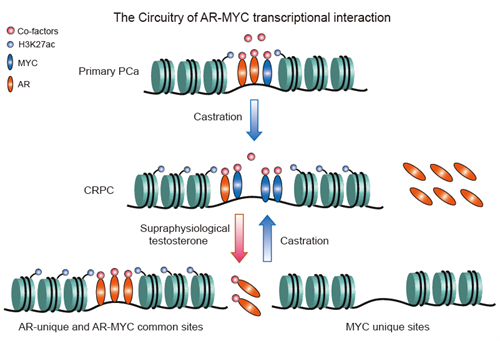
相比低级别前列腺癌(primary PCa),CRPC中AR的表达显著增加,从而极大强化了AR的激活对前列腺癌细胞中基因转录的影响。相比primary PCa细胞,雄激素刺激在CRPC细胞中引起的上调和下调基因数目中均显著增加。但分析表明AR的直接作用是转录激活,AR活化后受到间接抑制的那部分基因被哪些转录因子直接调控尚不明确。通过系统分析,团队发现在CRPC细胞中,转录因子MYC在雄激素刺激后的早期就出现了表达下降,且MYC的DNA结合基序富集于被雄激素抑制的基因附近增强子中,提示了MYC对这部分基因的调控潜能。进一步的分析发现,在CRPC细胞中MYC蛋白结合于受雄激素抑制基因附近,并且促进这些基因的表达。由于这部分基因中富含促进细胞增殖相关的基因,因此雄激素的刺激通过抑制转录因子MYC的表达,进而抑制了CRPC细胞的增殖。另一方面,团队观察到在primary PCa细胞中,雄激素的刺激并不抑制MYC的表达,但在primary PCa细胞中过表达AR后雄激素的刺激则能有效抑制MYC的表达,并能够大幅提升上调和下调的基因数目。这提示雄激素对MYC的表达抑制依赖于细胞内较高的AR水平。进一步的研究证实,相比primary PCa细胞,CRPC细胞中AR和MYC都出现了极为显著的高表达。因此,当CRPC细胞中AR被雄激素大量活化时,细胞核中的转录共激活因子被活化的AR耗竭一空,一方面导致MYC染色质结合位点处的转录共激活因子(例如BRD4)下降,另一方面直接抑制MYC本身的转录激活,从而抑制了细胞增殖相关基因(MYC靶基因)的表达。而在primary PCa细胞中,由于AR表达未达到极高水平,即使AR被活化也无法完全耗尽细胞核内的转录共激活因子,因此雄激素刺激并不能抑制MYC及其靶基因的表达。
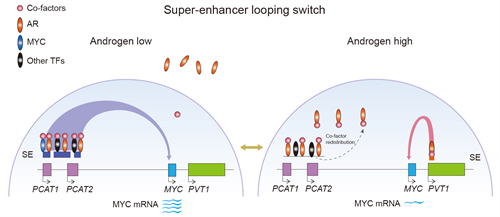
研究团队进而对CRPC细胞中雄激素抑制MYC表达的机制进行了深入探讨,发现MYC基因上游~700kb处存在一个活性极高的超级增强子。团队利用染色质构象捕获数字PCR(3C-ddPCR)、4C-Seq和HiChIP等多种三维基因组学技术,证实该超级增强子与MYC启动子具有坚实的远程互作,从而促进MYC在CRPC细胞中的高表达。而雄激素刺激后,MYC上游超级增强子处的转录共激活因子被虹吸效应转移到染色质上AR结合增强的位点,致使该超级增强子活性下降,并且其与MYC启动子的结合大幅减弱,从而导致MYC表达的下调。
本研究揭示了前列腺癌中转录因子AR和MYC活性的动态平衡机制,提示雄激素剥夺疗法导致的MYC表达上调可能是促进去势抵抗前列腺癌发生的重要因素,而超生理剂量的雄激素疗法可能是通过抑制MYC的表达使CRPC患者受益。
本研究由哈佛大学、多伦多大学和山东大学等单位合作完成,哈佛大学贝斯以色列女执事医学中心的Steven P. Balk教授、Shaoyong Chen博士以及多伦多大学玛格丽特公主癌症中心的Housheng Hansen He教授为本文的通讯作者,山东大学第二医院检验医学中心郭海洋研究员和复旦大学生物医学研究院吴一鸣为本文的共同第一作者,山东大学为本论文的第一作者单位。
原文链接:https://doi.org/10.1038/s41467-021-27077-y
郭海洋研究员长期致力肿瘤表观基因组和三维基因组的研究,揭示了转录因子ONECUT2、Sox2、MYC以及染色质重塑蛋白Arid1a等在前列腺癌和胃癌发生发展中的表观遗传学作用机制。相关研究性工作以第一/通讯作者身份发表于Nature Genetics(2016)、Nature Communications(2019)、Science Advances(2019)、JEM(2021)等期刊。
郭海洋课题组(邮箱:haiyang.guo@email.sdu.edu.cn)长期招聘分子生物学或生物信息学方向的博士后,并培养相关方向博士研究生,详细信息请参见:https://faculty.sdu.edu.cn/guohaiyang1/zh_CN/index.htm
{作者:杜鲁涛 来源:科研与国际合作交流部 编辑:宣传部/新闻中心}
相关新闻
【公益行动】名医走基层 志愿服务行——山大二院“太阳正红”资深专家服务队持续走进山东大学宿舍义诊
为落实国家卫健委名医走基层、志愿服务行文件精神,深入贯彻健康中国战略,提高辖区居民的健康意识和自我保健能力,4月15日,山东大学第二...


【医院新闻】央视关注山大二院“体重管理”工作
<p>4月14日,中央电视台1套综合频道《晚间新闻》以《健康中国在行动 体重管理怎么“管”?》为题,报道了山东大学第二医院(以下简称山大...

【医院新闻】山东大学第二医院与淄博一四八医院开展专科联盟合作
4月15日,山东大学第二医院与淄博一四八医院专科联盟揭牌仪式在淄博举行。山东大学第二医院副院长靳斌,淄博一四八医院院长闫波、纪委书记...


友情链接: 中华人民共和国国家卫生健康委员会 | 山东省卫生健康委员会 | 山东大学 | 山东大学齐鲁医学院 | 国家卫健委委属、委管医院 | 山东大学第二医院南部院区 | 山东善德投资有限公司
版权所有:山东大学第二医院ICP备案: 鲁ICP备12024819号-7 鲁公网安备 37010502000474号
地址:山东省济南市北园大街247号预约咨询热线:0531-88197777